Primeiro Princípio da Termodinâmica ou Princípio da Conservação da Energia
Resolução comentada dos exercícios de vestibulares sobre
Primeiro Princípio da Termodinâmica ou Princípio da Conservação da Energia
01- Se a temperatura é a mesma para gases diferentes, a energia cinética das moléculas deve ser a mesma, independente da massa de cada gás. Como Ec=mV2/2 e a energia cinética é a mesma o gás de maior massa deve ter menor velocidade para que essas energias se igualem — R- C
02-
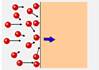
A pressão exercida por um gás é o resultado das colisões das moléculas do gás entre si e contra as paredes do recipiente — R- C
03- 01. Falsa — O postulado básico da teoria cinética dos gases é que as direções e as intensidades das velocidades das moléculas estão distribuídas ao acaso, ou seja, são diferentes para cada molécula do gás.
02. Verdadeira — veja teoria.
03- Verdadeira — veja teoria
04. Verdadeira — veja teoria.
R- 01-F,=; 02-V; 3-V; 4-V
04- (01) Verdadeira — como estão em equilíbrio térmico com o ambiente, possuem a mesma temperatura, consequentemente suas moléculas terão a mesma energia cinética média — mam.(Vam)2/2= mar.(Var)2/2 — observe na expressão anterior que, para que a igualdade se mantenha, quanto maior a massa das moléculas, menor será sua velocidade.
(02) Falsa — o som transporta energia, não transporta matéria.
(04) Verdadeira — quanto maior a temperatura, maior a velocidade de agitação das moléculas de amônia.
(08) Falsa — a perturbação de pressão corresponde a uma onda, cuja velocidade de propagação depende do meio.
(16) Verdadeira — veja teoria.
R- (01 + 04 + 16) = 21
05- R- B — veja teoria
06- R- E — veja teoria
07- Quanto maior a velocidade de agitação das moléculas, elas escaparão com maior facilidade — R- C
08- 01. Falsa — calor é energia que é transferida de um corpo para outro devido à diferença de temperatura entre eles e é transferida sempre do corpo de maior temperatura para o de menor temperatura. Portanto não é energia armazenada.
02. Falsa — veja 01.
04. Falsa — veja 01.
08. Correta — veja 01.
16. Falsa — veja 01
32. Verdadeira — como a temperatura do termômetro aumenta, sua energia interna também aumentará.
R- (08 + 32) = 40
09- R- C e E — veja teoria.
10- W=P.(V2 – V1) — V1=V2 — W=0 — R- C
11- W=P.(V2 – V1) — V2<V1 (compressão) — W<0 — R- C
12- R- C — veja teoria
13- Isotérmica — Q=W — Q=W=150J — adiabática — mesmo trabalho — W=150J — ΔU=-W — ΔU=-150J
14- a) W=P.ΔV=50.8 — W=400J
b) ΔU=Q´gás – W — ΔU=(2.000 – 1.500) – 400 — ΔU=500 – 400 — ΔU=100J
c) aumenta, pois o gás teve aumento de temperatura, devido ao aumento de energia interna.
15- W=P.(V – Vo)=20.(10 – 5) — W=100J — Q=250J — ΔU=Q – W=250 – 100=150J — R- B
16- È possível um gás receber calor e sua temperatura não sofrer variação desde que seja uma transformação isotérmica onde todo calor recebido é transformado em trabalho, pois, sendo ΔU=0 — Q=W — R- E
17- Mesma variação de temperatura (ΔT) — mesma variação de energia interna (ΔU) — ΔU1= ΔU2= ΔU — isovolumétrica — ΔU1=Q1= ΔU — isobárica — ΔU2=Q2 – W — ΔU=Q2 – W — Q1=Q2 – W — Q2 – Q1=W — Q2>Q1 — R- A
18- R- C — veja teoria
19- Variação de energia interna — ΔU= Ufinal – Uinicial=20,8Tfinal – 20,8Tinicial — ΔU=20,8 ΔT — ΔU=Q – W — adiabática Q=0 (não houve trocas de calor) — ΔU=0 – W — ΔU=-W — 20,8 ΔT= -1.664 — ΔT= – 80K — R- C
20- a) WAB=área=b.h=2.4.105 — WAB=8.105J — WBC=0 (volume não varia) — Wtotal=WAB + WBC=8.105 + 0 — Wtotal=8.105J
b) observe que os pontos A e C estão sobre a mesma isoterma e, portanto, possuem a mesma temperatura e consequentemente a mesma energia interna — ΔU=0 — ΔU=Q – W — 0=Q – W — Q=W=8.105J
21- Está transformando calor em trabalho — R- A
22- Observe que se trata de uma transformação isobárica — ocorre à pressão constante — a variação de temperatura (ΔT) provoca uma variação de energia interna (ΔU) do sistema e a variação de volume (ΔV) produz trabalho. Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU=Q – W — observe que W>0 (expansão isobárica) — R- D
23-

24- Trata-se de uma expansão adiabática (muito rápida e sem troca de calor com o meio ambiente), onde Q=0 e ΔU= Q – W —
ΔU= 0 – W — ΔU= – W — o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura e a pressão — o gás resfria — R- A
25- No trecho AB, como se trata de uma isobárica V/T=K — como o volume aumenta a temperatura também deve aumentar provocando um aumento da energia interna — Falsa
– O trecho BC corresponde a uma isotérmica (mesma temperatura) — Falsa
– O trecho CA corresponde a outra isotérmica (T constante) — Q=0 — ΔU=Q – W — ΔU=0 – W — ΔU= – W — como o volume varia, a existe trabalho e, portanto ΔU também varia — Falsa
R- E
26-Trecho AB — isotérmica — PAVA=PBVB — PA.0,1=0,5.105.0,5 — PA=2,5.105N/m2 — Verdadeira
Trecho AB — isotérmica — ΔU=0 — Q=W — todo calor Q recebido pelo sistema é totalmente transformado em trabalho — Falsa
Trecho BC — isobárica — W=b.h=(0,1 – 0,5).0,5.105 — W= – 2,0.104J — Falsa
Trecho CA — isovolumétrica — W=0 — Verdadeira
Falsa — observe que o W no trecho CD é negativo e que o trabalho no ciclo é a soma das áreas do trabalho de cada trecho.
R- V F F V F
27- Nos dois processos a temperatura interna do ar dentro da bola permanece constante — trata-se de uma isoterma, que é curva — R- B
28- Como o volume é constante, trata-se de uma isovolumétrica o — P/T=constante — mas V também é constante — R- D
29- Adiabática — Q=0 — ΔU=Q – W — ΔU=-W — W + ΔU=0 — 249 + (3/2)RΔT=0 — 249 + (3/2).8,3.(T – To)=0 —
249 + (3/2).8,3.(T – 333)=0 — 249 + 12,45.(T – 333)=0 — (T -333)=-249/12,45 — T=333 – 20 — T=313K=40oC
30- I. Falsa — a parede não permite trocas de calor (é adiabática)
II. Verdadeira — o recipiente com maior temperatura faz maior pressão na parede.
III. Falsa
R- B
31-

32- R- A
33- R- D — veja teoria
34- Sendo o trabalho realizado numa transformação cíclica é fornecido pelo cálculo da área do ciclo — R- E
35-

36- Trata-se de uma expansão adiabática (muito rápida e sem troca de calor com o meio ambiente), onde Q=0 e ΔU= Q – W — ΔU= 0 – W — ΔU= – W — o volume do gás aumenta (trabalho positivo) fazendo com que a energia interna (ΔU) fique negativa e diminua, diminuindo assim, a pressão e a temperatura e a pressão, e o gás resfria — R- D
37- 01. Falsa — o trabalho total é fornecido pela soma das áreas das duas transformações.
02. Correta — ΔU=100J — W=área do trapézio + área do retângulo=(B + b).h/2 + b.h =(120 + 40).4/2 + 8.120 — W= 320 + 960=1.280J — ΔU=Q – W — 100=Q – 1.280 — Q=1.380J.
04. Falsa — são duas transformações e nenhuma delas isotérmica (gráfico é uma curva).
08. Correta — veja 02.
16- Falsa — Falsa — houve trocas de calor — veja 02.
R- (02 + 08) = 10
38- W=P.ΔV=1,1.105.(4.10-3 – 2.10-2) — W=2,2.102J — ΔU=Q – W=5,5.102 – 2,2.102 — ΔU=3,3.102J — R- D
39- A energia interna do sistema aumentará, fazendo com que o gás realize trabalho se expandindo e deslocando o êmbolo da seringa —
R- B
40- Pela 1ª lei da Termodinâmica — Q = W + DU — como A e B estão na mesma isoterma tem a mesma temperatura e então DU = 0 — logo Q = W, onde W é o trabalho realizado entre A e B. Este trabalho é igual a área do diagrama PV neste intervalo — para o cálculo da área é necessário determinar a pressão do ponto B — como A e B estão na mesma isoterma — PV = constante — p0.V0 = p.V0/3 ![]() p = 3.p0 — QAB = (p0 + 3p0).(V0 – V0/3)/2 = 4p0.(2V0/3)/2 — QAB = 4p0V0/3
p = 3.p0 — QAB = (p0 + 3p0).(V0 – V0/3)/2 = 4p0.(2V0/3)/2 — QAB = 4p0V0/3
41- I. Correta — as temperaturas finais e iniciais de ambos são as mesmas — mesma ΔT — mesma ΔU.
II. Falsa — isocórica — ΔU= Q – W — Q= ΔU + W — isocórico — W=0 — ΔU= Q – W — Q= ΔU.
III. Correta — a isoterma que contém Tx está mais afastada dos eixos que a isoterma que contém To.
R- C
42- a) Os processos isotérmicos (curvas) são os trechos AB e CD — os isocóricos correspondem às retas verticais.
b) AB — isotérmica — PAVA=PBVB — 3Patm.Vo=PB.2Vo — PB=3Patm/2 — DC — isotérmica — PDVD=PCVC — Patm.Vo=PC.2Vo — PC=Patm/2
c) AD — isocórica — PA/TA=PD/TD — 3Patm/TA=Patm/TD — TA/TD=3
43-

44- Nas transformações isobáricas a pressão permanece constante, variando assim, o volume e a temperatura. Se a temperatura varia a energia interna varia, o que invalida a opção A.
Nas transformações isométricas o volume permanece constante, e desta forma, pressão e temperatura variarão, o que invalida a opção B.
Não há trabalho, de fato se o volume não varia, nas transformações isométricas ou isovolumétricas. O que invalida a opção D.
Nas transformações isométricas apenas o volume permanece constante, a pressão e a temperatura variam, o que invalida a opção E.
Apenas na opção C temos correção, pois de fato nas transformações adiabáticas não há troca de calor entre o gás e o recipiente, além é claro do meio externo.
R- C
45- a) trecho AB — isobárica — W=P.(V – Vo)-105.(70.10-4 – 20.10-4) — W=500J — ΔU=Q – W — 1.000=Q – 500 — Q=1.500J
b) trecho BC — isovolumétrica — W=0 — o volume não varia
c) PB/TB=PC/TC — 105/350=PC/700 — PC=2.105N/m2 (Pa)
46- Q = U + WAB + WBC — Q = U + PA (VB – VA) + W — R- D
47- a) Equação geral dos gases perfeitos — P1V1/T1=P2V2/T2 — isobárica — V1/T1=V2/T2 — 2.10-3/300=3,5.10-3/T2 — T2=525K
b) Primeira lei da termodinâmica, a variação da energia interna (DU) é igual à diferença entre o calor recebido (Q) e o trabalho realizado (W) — DU = Q – W — isobárica, o trabalho realizado é — W = p DV — DU = Q – p DV = 375 – 105(3,5 ´ 10-3 – 2 ´ 10-3) = 375 – 105(1,5 ´ 10-3) — DU = 375 – 150 — DU = 225 J
48- Observe as figuras abaixo:
Nas figuras ao lado — A: área da secção transversal do êmbolo — FE: módulo da força elástica — FE = k x — FG: módulo da força de pressão exercida pelo gás — FG = P A — Dados: P0; V0; V = 2 V0 e n = 1 mol — o sistema está termicamente isolado, ou seja, a transformação é adiabática (Q = 0) — 1ª lei da termodinâmica — DU = Q – W — DU = 0 – W — W = – DU — W =-(3/2)nRT = -(3/2).(1)R.(T – To) — W=3/2.R.(To – T) — esse trabalho é armazenado na mola na forma de energia potencial elástica — KX2/2=(3/2).R.(To – T) — kx2=3R.(To – T) (I) — volume inicial do êmbolo — Vo=A.x — x=Vo/A (II) — na figura (b), na posição de equilíbrio — FE = FG Þ k x = P A (III) — as equações (II) e (III) sugerem que — k x2 = (k x) (x) = (P A).(Vo/A) — k x2 = P V0(IV) — novamente na figura (b) — PV=nRT — P (2V0) = (1) R T — P V0 =RT/2 (V) — (IV) e (V) — 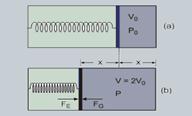
k x2 =RT/2 — substituindo essa expressão na equação (I), temos — RT/2=3R(To – T) — T = 6(T0 – T) — 7T = 6 T0 — T=(6/7)tO.
49- (01) Correta — da equação geral dos gases perfeitos — P1V1/T1=P2V2/T2 — como T1 = T2 — p1V1 = p2V2.
(02) Correta — ao ser comprimido bruscamente, o ar sofre aquecimento, perdendo calor para o meio externo (água e gelo), provocando fusão de certa massa de gelo.
(04) Correta — como já afirmado na proposição anterior, a compressão é brusca, o gás aquece rapidamente, sendo toda a energia transferida na compressão transformada em energia interna do ar, pois, nesse intervalo de tempo tão pequeno a quantidade de calor que atravessa as paredes do cilindro é praticamente nula, o que caracteriza uma transformação é adiabática — a seguir, o gás começa a perder calor para o sistema água-gelo, sob pressão constante, que é a pressão exercida pela força de compressão que o tijolo provoca no êmbolo, que tem a mesma intensidade de seu peso, constante — então, a pressão é constante, caracterizando uma transformação isobárica.
(08) Errada — já justificado nas proposições anteriores.
(16) Errada — Já justificado nas proposições anteriores.
R- (01+ 02 + 04) = 07
50- 01) Falsa — numa transformação isotérmica, a variação da energia interna (DU) é nula — logo, o calor (Q) recebido é transformado integralmente em trabalho (W), como indica a primeira lei da termodinâmica — Q = DU + W — Q = 0 + W — Q = W.
02) Correta — dados: PAB = 8 ´ 105 Pa e DVAB = 2 ´ 10-3 m3 — WAB = PAB DVAB = (8 ´ 105 ) (2 ´ 10-3) = 16 ´ 102 = 1,6 ´ 103 J — WAB=1,6 kJ.
04) Correta — aplicando a lei geral dos gases ideais para os estados A e B — PBVB/T1=PCVC/T1 — 5/900=7/T2 — T2=1.260K — lei geral dos gases ideais para os estados B e C — PBVB/T1=PCVC/T1 — 8 ´ 105 ´ 7 ´ 10-3 = pC (9 ´ 10-3) —
Pc=56.105/9 — pC @ 6,22.105 Pa.
08) Falsa — a temperatura final é igual à inicial, mas ao longo do ciclo há aquecimentos e resfriamentos.
16) Falsa — a transformação CD é uma expansão adiabática, pois VD > VC.
32) Correta — a transformação EA é isocórica (WEA = 0) — da primeira lei da termodinâmica — Q = DU + W — Q = DU + 0 — Q = DU.
R- (02 + 04 +32)=38
51- a) Observe os processos indicados no gráfico — de para b é um processo isocórico — ∆V = 0 — ∆P= (1,0.105 – 3,0.105)=
-2.105 Pa — de b para c o processo é isobárico — ∆V=(6.10-2 – 2.10-2)= 4.10-2 m3 — entre a e c — Pa.Va/Ta = Pb.Vb/Tb —
3.105.2.10-2/Ta = 1.105.6.10-2/Tc — Ta/Tc=1
b) Energia interna do gás — U=3/2nRT — Ta=Tc (veja ítem anterior) — como n e R são constantes você conclui que —
Ua=Uc e que ∆Uac=0 — ∆Uac=Qac – Wac — 0=Qac – Wac — Qac=Wac — Wac=Wab + Wbc — Wac=0 + Wbc — Wac=Wbc=
1.105.(6 – 2).10-2 — Qac=Wac=4,0.103 J
52-
R- C
53-

54- Os biocombustiveis de primeira geração são produzidos a partir da fermentação alcoólica dos açúcares vegetais da biomassa que contenha amido ou sacarose, como por exemplo o milho, o trigo, o sorgo, o amendoim, a soja, a beterraba, a batata doce, o girassol e a cana-de-açúcar, não utilizando a celulose — porém, para evitar que se atinja o limite da oferta ou venha a ocorrer a competição pelo uso da terra para a produção de biocombustíveis e de alimentos, é necessário investir no desenvolvimento de tecnologias de segunda geração para produção de etanol com o aproveitamento eficiente da celulose — estimativa é de que o aproveitamento do bagaço e parte das palhas e pontas da cana-de-açúcar eleve a produção de álcool em 30% a 40%, para uma mesma área plantada — demais matérias-primas para as quais se buscam tecnologias de processamento da celulose, tais como capim-elefante, braquiárias, panicuns e árvores de crescimento rápido podem representar alternativas competitivas e eficientes para locais onde não se cultiva ou cultivará cana-de-açúcar, podendo gerar novos empregos — R- A.
55- Pode-se definir o Segundo Princípio da Termodinâmica da seguinte maneira: “É impossível obter uma máquina térmica que, operando em ciclos, seja capaz de transformar totalmente o calor por ela recebido em trabalho” — sempre haverá energia dissipada pelo motor — R- C.
56- Veja a teoria a seguir:
É um modelo teórico. É um gás que obedece às equações p·V/T = k e p·V = n·R·T — o modelo adotado para um gás ideal compreende a Teoria Cinética Molecular dos Gases, cujos aspectos fundamentais são:
* A pressão do gás é exercida igualmente em todos os pontos do recipiente;
* Os choques entre as moléculas são elásticos;
* As moléculas de um gás são pontos materiais, ou seja, possuem massa, mas apresentam um volume praticamente nulo;
* Em um gás ideal não há atração nem repulsão entre as moléculas.
[A] Correta — veja teoria.
[B] Falsa — veja teoria.
[C] Falsa — se V é constante — P.V/T=k (constante) — observe nessa expressão que P é diretamente proporcional a T.
[D] Falsa — P.V=k — P e V são inversamente proporcionais.
[E] Falsa — V/T=k — V e T são diretamente proporcionais.
57- Ocorre à pressão constante. A variação de temperatura (ΔT) provoca uma variação de energia interna (ΔU) do
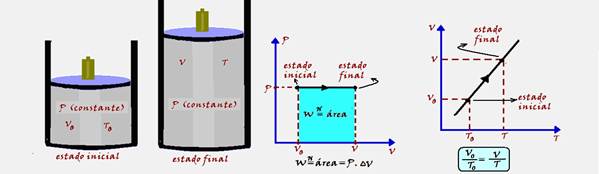
sistema e a variação de volume (ΔV) produz trabalho. Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU=Q – W.
![]()
Cálculo do trabalho realizado pelo ambiente sobre o gás — W=P.∆V=4.103.(-2.10-1) — W= – 8.102 J (negativo, volume diminui) — Q= – 1,8.103 J (negativo, perde calor) — ΔU=Q – W= – 1,8.103 – ( – 8.102) — ΔU= – 1,8.103 + 0,8.103 — ΔU= – 1,0.103 J negativo, a temperatura diminui) — R- D.
Voltar para os exercícios
