Resolução Comentada – FÍSICA TÉRMICA – 2014/2013
Vestibulares Recentes – Resolução Comentada
FÍSICA TÉRMICA – 2014/2013
01- Quando a temperatura for de T=185oC — 185=160.2-0,8t + 25 — 160=160.2-0,8t — 160/160=2-0,8t — 1=2-0,8t — 20=2-0,8t — 0,8t=0 — t=0 (quando T=185oC, começou a contagem do tempo) — quando a temperatura for de T=65oC — 65=160.2-0,8t + 25 — 40=160.2-0,8t — 40/160=2-0,8t — 1/4=2-0,8t — 2-2=2-0,8t — 0,6t=2 — t=20/8=2,5min — R- C
02-
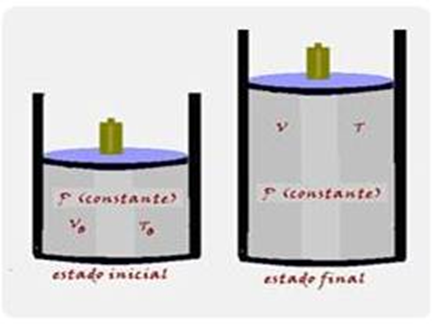
Transformação isotérmica
Nela, durante todo o processo, a temperatura permanece constante (isso=igual; termos= temperatura). O cientista Robert Boyle comprovou que, quando a temperatura é constante, a pressão (P) exercida por certa massa gasosa é inversamente proporcional ao volume (V) por ela ocupado — ou — P.V=constante — ou ainda — Po.Vo=P.V — Po e Vo representam a pressão e o volume num estado de equilíbrio inicial — P e V representam a pressão e o volume num estado de equilíbrio final.
![]()
R- B
03-
a) É claro que se você misturar 10g de álcool com 1000L=1000kg=106g de água, praticamente não haverá alteração na temperatura da água que continuará 33oC, conforme resolução a seguir:
Quantidade de calor cedido pelo álcool — Qal=mal.cal.(te – to)=10.0,6.(te – 70) — Qal=6te – 420.
Quantidade de calor recebido pela água — Qag=mag.cag.(te – to)=106.1.(te – 33) — Qag= 106te – 33.106.
Supondo que eles troquem calor apenas entre si — Qal = Qag — 6te – 420 = 106te – 33.106 — 106te – 6te = 33.106 – 420 — te≈33.106/106 — te≈33oC.
A quantidade de calor que a água recebe é, em módulo, a mesma que o álcool cede e vale — Qal=6.(33 – 70) — Qal= – 222 cal — (o sinal negativo significa apenas que o álcool está cedendo calor à água) — assim, a água recebe Qag=222 cal.
b) A entropia do reservatório de água é dada por — ΔSag =Qag/T=222/(33 + 273)=222/306 — ΔSag=0,73ca/K.
O enunciado fornece que a variação de entropia do sistema (reservatório de água e a gota de álcool) é ΔSsistema ≥ 0 —ΔSsistema = ΔSag +ΔSal ≥ 0.
Como a gota de álcool está cedendo calor, sua variação de entropia será negativa.
Assim, a variação de entropia da gota de álcool vale ΔSal ≥ −0, 73cal/H.
04- 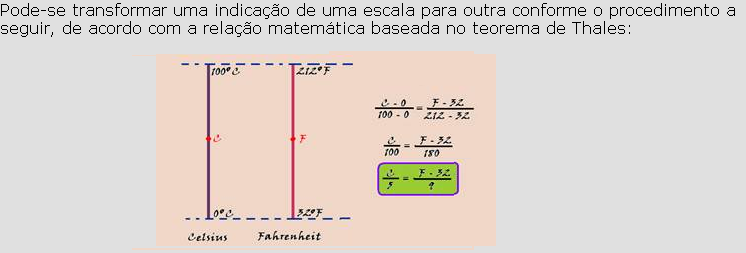
C/5 = (87,8 – 32)/9 — C/5 = 55,8/9 — 9C=279 — C=31oC.
R- B
05- I. Correta — em Florianópolis a água ferve a 100oC e em Lages, a 97oC e, assim, em Florianópolis ficam, no mesmo tempo que em Lages, a uma temperatura maior.
II. Correta — a temperatura de ebulição está relacionada com a pressão — maior pressão, maior temperatura de ebulição.
III. Correta — Veja (II)
IV. Falsa — a panela de pressão aumenta a pressão interna fazendo com que a temperatura de ebulição fique maior que 100oC, e deve ser usada em Lages onde a temperatura de ebulição é menor.
R- A
06- Observe no gráfico que, quando C=0oC, X=25oX e que, quando C=10oC, X=85oX.
Equação de conversão:
Pode-se transformar uma indicação de uma escala para outra conforme o procedimento a seguir, de acordo com a relação matemática baseada no teorema de Thales:
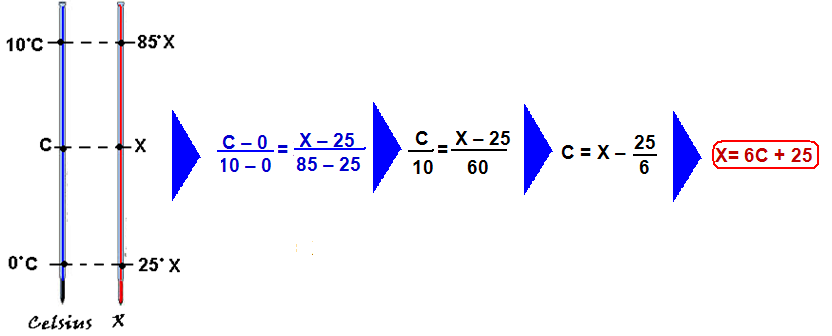
Calor específico (sensível da liga metálica — Cl=0,1cal/(g.oX) — observe que, para cada variação de 10oC (10 – 0) na Celsius, ocorre uma variação de 60oX (85 – 25) na escala X.
Regra de três:
![]()
Portanto cl = 0,1o g/(cal.oX)=0,1 cal/g.(1/6)oC — cl=0,6 cal/goC

Qa + Ql = 0 — 100t – 2000 + 120t – 9000 = 0 — t=11000/220 — t=50oC.
07- Pelo enunciado, durante o processo de varredura ocorre a formação de uma película de água líquida entre a pedra e a pista, ou seja, está havendo uma fusão, uma passagem do estado sólido para o líquido.
Assim, a transformação promovida pela varredura é a de número 1.
08- Após a queima de 4,00g de carvão, a temperatura interna do calorímetro aumentou de Δθ=(31,3 – 20,0)=11,3oC.
Capacidade térmica=variação da quantidade de calor/variação da temperatura — C=ΔQ/Δθ —
21,4=ΔQ/11,3 — ΔQ=241,82kcal.
O exercício pede a quantidade de calor, em kcal/g (kcal por cada grama), liberada na queima do carvão — regra de três — 4g – 241,82kcal — 1g – Q — 4Q=241,82 — Q=60,45kcal.
R- E
09- Nas regiões desérticas a amplitude térmica (diferença entre a máxima e mínima temperaturas) é bastante elevada e nas regiões litorâneas ela é bem menor devido ao alto calor específico da água em relação a outras substâncias, é que ela pode absorver ou ceder grandes quantidades de calor

com pequena alteração de temperatura. Isto ocorre devido às pontes de hidrogênio que mantêm as moléculas unidas. Nas regiões desérticas a ausência de água faz um ambiente possuir um baixo calor específico, e desta forma o ambiente se aquece facilmente e se arrefece facilmente.
R- B
10- Lâminas bimetálicas – Quando você solda duas barras de materiais diferentes você obtém uma lâmina bimetálica e, se você as submeter à mesma variação de temperatura, o sistema vai curvar-se para o lado da barra de menor coeficiente de dilatação (se dilata menos, ferro), quando aquecida e para o lado da barra de maior coeficiente de dilatação (se dilata menos, bronze), quando resfriada, pois ∆L=Lo.α.∆Ɵ e, nesta expressão a dilatação ∆L é diretamente proporcional ao coeficiente de dilatação α — R- D
11- Cálculo da energia liberada numa queda livre pelas duas massas de mtotal=6 + 4=10kg caindo de uma altura de h=2m — como caem com velocidade constante não existe variação de energia cinética, apenas de energia potencial gravitacional — assim, a energia mecânica passou de Emi=mgh=10.10.2=200J para Emf=mgh=10.10.0=0 — ΔEm=200 – 0=200J — para 40 quedas —ΔEm=40.200=8000J — pelo enunciado toda essa energia foi utilizada no aquecimento de m=1kg =1000g de água, de calor específico c=4,0J/goC produzindo um aquecimento ΔӨ de — ΔEm = Q=mc ΔӨ — 8000 = 103.4.ΔӨ — ΔӨ=8000/4000 — ΔӨ = 2oC.
12- Pelo enunciado as temperaturas final e inicial são iguais, portanto trata-se de uma transformação isotérmica (mesma temperatura T) onde P.V=constante. Observe nessa expressão que, depois de aberta a válvula o gás dobra seu volume e, para que o produto PxV seja constante a pressão anterior P1 deve cair pela metade — R- A
13- Se você não domina a teoria, ela está a seguir:
Capacidade térmica (C)
![]() Define-se capacidade térmica (C) ou capacidade calorífica de um corpo como sendo o produto da massa desse corpo pelo calor específico da substância de que ele é constituído, ou seja, — C=m.c — como Q=m.c.Δt — Q=C.Δt — ou Q=C/(t – to)
Define-se capacidade térmica (C) ou capacidade calorífica de um corpo como sendo o produto da massa desse corpo pelo calor específico da substância de que ele é constituído, ou seja, — C=m.c — como Q=m.c.Δt — Q=C.Δt — ou Q=C/(t – to)
![]()
Se, por exemplo, a capacidade térmica de um corpo é C=40cal/oC, isto significa que, quando esse corpo receber ou ceder 40 calorias, sua temperatura aumentará ou diminuirá de 1 oC.
Princípio das trocas de calor
![]() Colocando vários corpos a diferentes temperaturas no interior de um recipiente adiabático, haverá trocas de calor entre eles, até atingirem o equilíbrio térmico. Assim , como o recipiente é adiabático, a quantidade de calor cedida pelos corpos mais quentes é igual à quantidade de calor recebida pelos mais frios:
Colocando vários corpos a diferentes temperaturas no interior de um recipiente adiabático, haverá trocas de calor entre eles, até atingirem o equilíbrio térmico. Assim , como o recipiente é adiabático, a quantidade de calor cedida pelos corpos mais quentes é igual à quantidade de calor recebida pelos mais frios:
Princípio da Conservação da energia.
Como a quantidade de calor recebida é positiva e a cedida é negativa, tem-se que — Q1 + Q2 + Q3 + ….+ QN = 0 ou m1.c1.(t – to1) + m2.c2.(t – to2) + m3.c3.(t – to3) + … + mN.cN.(t – toN) = 0
No exercício:
Esfera metálica — to=50oC — C=mc=2cal/oC — tequilíbrio=?
Água — to=30oC — C=mc=2000cal/oC — tequilíbrio=?
ma.ca.(tequilíbrio – to) + me.ce.(tequilíbrio – to)=0 — Ca.(tequilíbrio – to) + Ce.(tequilíbrio – to)=0 — 2000.(tequilíbrio – 30) + 2.(tequilíbrio – 50)=0 — 2000.tequilíbrio – 60000 + 2.tequilíbrio – 100=0 — 2002.tequilíbrio = 60100 —
tequilíbrio=60100/2002=30,01oC
R- B
14-
Relação entre as escalas
Pode-se transformar uma indicação de uma escala para outra conforme o procedimento a seguir, de acordo com a relação matemática baseada no teorema de Thales:
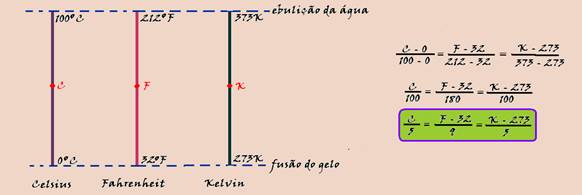
C/5 =K – (273)/5 — C=K – 273=313 – 273 — C=40oC
R- C
15- A teoria é fornecida a seguir:
![]() Denomina-se calor sensível ou calor específico (c) o calor que provoca uma variação na temperatura de um corpo, sem que ele mude de estado físico.
Denomina-se calor sensível ou calor específico (c) o calor que provoca uma variação na temperatura de um corpo, sem que ele mude de estado físico.
Verifica-se experimentalmente que a quantidade de calor (Q) recebida ou cedida por um corpo é diretamente proporcional à sua massa e á sua variação de temperatura.
Matematicamente:
![]()
Onde c é o calor especifico (constante de proporcionalidade que é característica de cada corpo).
Características do calor específico:
![]() Substituindo m=1g e Δt=1 oC na expressão Q=m.c.Δt — Q=1.c.1 — Q=c — ou seja, o calor específico de uma substância é a quantidade de calor necessária para fazer a temperatura da massa de 1g ou 1kg dessa substância sofrer uma variação de temperatura de 1 oC.
Substituindo m=1g e Δt=1 oC na expressão Q=m.c.Δt — Q=1.c.1 — Q=c — ou seja, o calor específico de uma substância é a quantidade de calor necessária para fazer a temperatura da massa de 1g ou 1kg dessa substância sofrer uma variação de temperatura de 1 oC.
 Quando se afirma que o calor específico do álcool é 2400 J/(kg·ºC), quer-se dizer que, para uma massa de 1kg de álcool sofrer uma variação de temperatura de 1 oC, ela deve receber ou ceder,
Quando se afirma que o calor específico do álcool é 2400 J/(kg·ºC), quer-se dizer que, para uma massa de 1kg de álcool sofrer uma variação de temperatura de 1 oC, ela deve receber ou ceder,
2 400J de energia.
R- B
16-

R- A
17-
Relação entre as escalas termométricas
Pode-se transformar uma indicação de uma escala para outra conforme o procedimento a seguir, de acordo com a relação matemática baseada no teorema de Thales:


18- Isobárico, pressão constante — P=Po — Po.Vo/To=P.V/T — P.Vo/To=P.V/T — Vo/To=V/T —
Vo/473=V/673 — V/Vo=673/473= 1,4 — R- C
19- Relação entre os coeficientes de dilatação linear (α), superficial (β) e volumétrico (λ) — α/1= β/2 = λ/3 — Β=2α e λ=3α —chapa fina de lados Lo — So=Lo.Lo=Lo2 — dilatação com variação de temperatura
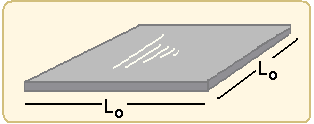
ΔT — ΔS=So.β.ΔT — ΔS=So.2α.ΔT (I) — dilatação com variação de temperatura 2ΔT — ΔS’=So.β.2ΔT — ΔS’=Lo2.2α.2ΔT — ΔS’=4Lo2.α.ΔT (II) — (I)/(II) — ΔS’/ΔS=4Lo2.α.ΔT / Lo2.2α.ΔT — ΔS’/ΔS=2 —
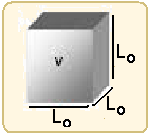
— cubo metálico de lados Lo — Vo=Lo.Lo.Lo==Lo3 — dilatação com variação de temperatura ΔT —
ΔV=Vo.λ.ΔT — ΔV=Lo3.3α.ΔT (I) — dilatação com variação de temperatura 2ΔT — ΔV’=Vo.λ.2ΔT — ΔV’=Lo3.3α.2ΔT — ΔV’=6Lo3.α.ΔT (II) — (I)/(II) — ΔV’/ΔV=6Lo3.α.ΔT / Lo3.3α.ΔT — ΔV’’/ΔV=2 —
R- B
20– Inversão térmica – ocorre quando as camadas de ar próximas à superfície da Terra, que deveriam ser mais quentes para poderem se expandir e levar os poluentes, ficam mais frias (daí o nome de inversão térmica).

Assim, o ar frio fica retido na superfície, aprisionado pelo ar quente, impedindo as correntes de convecção, pois o ar frio que fica em baixo é mais denso e mais pesado e encontra dificuldades para subir, o que retém os poluentes próximos à superfície. Essa poluição provoca problemas de saúde como bronquite, pneumonia, asma, cansaço, etc. que atingem os indivíduos mais frágeis como idosos, crianças e doentes
R- E
21- A fusão ocorre à temperatura constante de θ=40oC.
Quantidade de calor recebido no estado líquido — Q=3minx2.103 =6.103J — Q=m.c.Δθ — 6.103=
1.c.(70 – 40) — c=6.103/30 — c=0,2.103=200J/(kgK) — lembre-se de que cada variação de 1 grau na escala Celsius corresponde a variação e 1 grau na escala Kelvin.
R- E
22- W=0,1kJ — Quantidade de calor recebido no estado sólido — Q=3minx2.103 =6.103J=6kJ — segunda lei da termodinâmica — ΔU = Q – W = 6kJ – 0,1kJ=5,9kJ.
R- B
23-
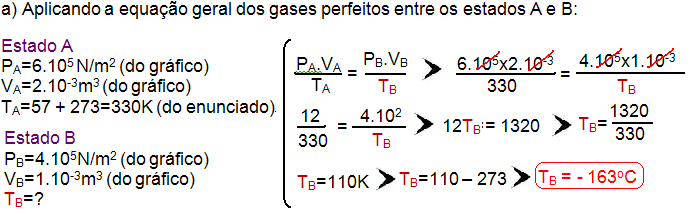
b) Cálculo do trabalho WAB recebido (trata-se de uma compressão, volume do gás diminuindo) pelo gás entre os estados A e B — esse trabalho é fornecido pela área entre A e B:
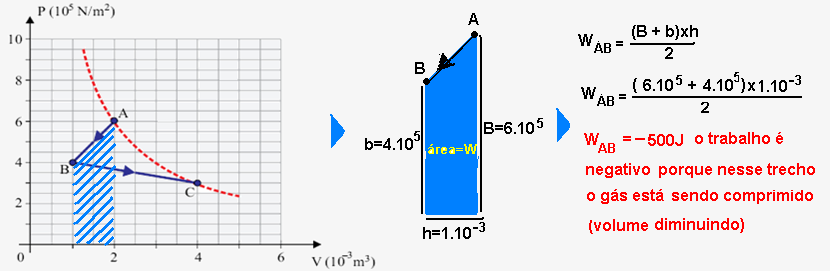
Cálculo da variação de energia interna no trecho AB (ΔUAB) pela aplicação do primeiro princípio da termodinâmica:
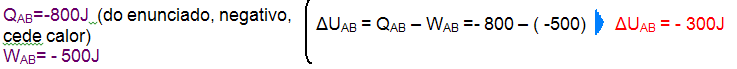
Cálculo do trabalho WBC cedido (trata-se de uma expansão, volume do gás aumentando) pelo gás entre os estados B e C —esse trabalho é fornecido pela área entre B e C:
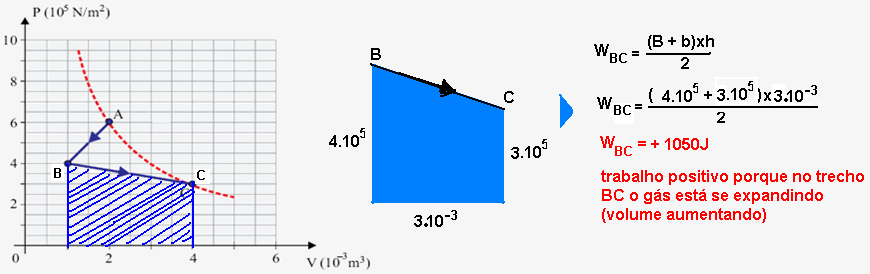
Cálculo da variação de energia interna no trecho BC — em toda transformação cíclica a variação de energia interna é nula ( a temperatura final coincide com a temperatura inicial) e, assim ΔUAB + ΔUBC + ΔUCA = 0 — -300 + + ΔUBC + + ΔUCA = 0 — mas ΔUCA=0 (A e C estão à mesma temperatura, mesma isoterma) — -300 + ΔUBC + 0 = 0 — ΔUBC=300J

24- O Primeiro Princípio da Termodinâmica (Princípio da Conservação da Energia) afirma que: “A energia não pode ser criada nem destruída, mas apenas transformada”
Suponha que um sistema isolado receba Q= 300J de calor. Se, por exemplo, ΔU=50J dessa energia forem absorvidos pelo sistema, então a parte restante, W=250J, será fornecida ao ambiente sob a forma de trabalho.

Então, Q= W + ΔU ou,
![]()
A expressão acima é a representação matemática do primeiro princípio da termodinâmica.
O exercício quer a variação de energia interna (ΔU) do gás entre os estados 1 e 2 em que a transformação é isobárica (pressão constante de P=1,2.105 Pa e o volume varia de V1 = 0,008 m3 a V2 = 0,012 m3 —
Cálculo do trabalho W realizado nessa transformação onde, numa transformação isobárica é válida a relação W=P.ΔV=1,2.105.(0,012 – 0,08)=1,2.105x0,004 — W=1,2.105x4.10-3 — W=4,8.102J=480J — é fornecido que nesse trecho o gás recebe Q= 500J de calor:
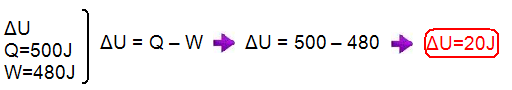
Entre os estados 1 e 3:

25-
I. Correta
Máquina 1 — temperatura da fonte fria em graus kelvin — Tf=227 + 273=500K — temperatura da fonte quente em graus kelvin — Tq=527 + 73=800K — o rendimento η de uma máquina de Carnot, em função da temperatura absoluta é fornecido por η1= 1 – Tf/Tq = 1 – 500/800= 1 – 5/8=3/8 — η1=0,375=37,5% — η1=37,5% Máquina 2 — temperatura da fonte fria em graus kelvin — Tf=227K — temperatura da fonte quente em graus kelvin — Tq=527K — o rendimento η de uma máquina de Carnot, em função da temperatura absoluta é fornecido por η2= 1 – Tf/Tq = 1 – 227/527=0,57 — η2=57% —
portanto η2 > η1
II. Falsa
É fornecido o trabalho realizado pela máquina 1 — W=2000J — rendimento da máquina 1, calculado em I — η1=0,375 — deve-se determinar a quantidade de calor Qq que a máquina recebe da fonte quente — a expressão que relaciona essas grandezas é — η1=W/Qq — 0,375=2000/Qq — Qq=2000/0,375≈5333,3J — esse valor é diferente de 6000J.
III. Correta
É fornecido que a máquina 2 retirou 4000J da fonte quente — Qq=4000J — rendimento da máquina 2 calculado em I — η2=0,57 — η2=W/Qq — 0,57=W/4000 — W=2280J — utilizando a relação a seguir — Qq= W + Qf — 4000=2280 + Qf —Qf=1720J.
IV. Falsa
Observe na expressão η = 1 – Qf/Qq que, para uma mesma quantidade de calor retirada da fonte quente, ou seja, para um mesmo Qq, o rendimento η e a quantidade de calor rejeitada para a fonte fria Qf são inversamente proporcionais — sendo η2> η1, Qf2 será menor que Qf1.
R- B.
26- Situação I. Transformação adiabática — Nela, o sistema não troca calor com o meio externo (Q=0) — ΔU=Q – W — ΔU=0 – W — ΔU= – W — a variação de energia interna ΔU é igual ao módulo do trabalho termodinâmico W — Situação II. Transformação isocórica, isométrica ou isovolumétrica — ocorre a volume constante — Vo=V — ΔV=0 — W=P.ΔV — W=P.0 — W=0 — ΔU = Q – W —
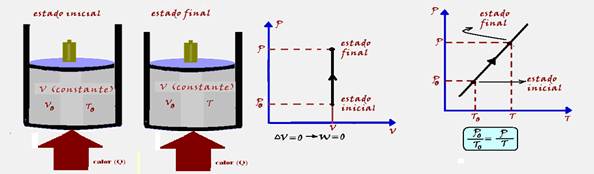
ΔU=Q – 0 — ΔU=Q — assim, todo o calor (Q) recebido (fluxo de calor) pelo sistema é igual à sua variação de energia interna (ΔU) ou à energia interna final do sistema — R- C
27- Se você não domina o conteúdo, leia as informações abaixo: Pode-se definir o Segundo Princípio da Termodinâmica da seguinte maneira: “É impossível obter uma máquina térmica que, operando em ciclos, seja capaz de transformar totalmente o calor por ela recebido em trabalho”
![]()
![]() Rendimento (η) de uma máquina térmica — η=energia útil/energia total=W/Q — exemplo: quando uma máquina térmica recebe, por exemplo, 300J de energia ou calor de uma fonte quente e só aproveita 150J desse calor na realização de trabalho (W), seu rendimento será — η=W/Q=150/300=0,5×100 — η=50%
Rendimento (η) de uma máquina térmica — η=energia útil/energia total=W/Q — exemplo: quando uma máquina térmica recebe, por exemplo, 300J de energia ou calor de uma fonte quente e só aproveita 150J desse calor na realização de trabalho (W), seu rendimento será — η=W/Q=150/300=0,5×100 — η=50%
Ciclo de Carnot
![]() Carnot estabeleceu que: Se uma máquina térmica operar em ciclos entre duas fontes térmicas,
Carnot estabeleceu que: Se uma máquina térmica operar em ciclos entre duas fontes térmicas,
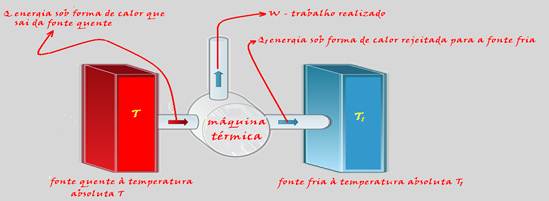
uma quente e outra fria, ela deve retirar calor (Q) da fonte quente, convertê-lo parcialmente em trabalho (W) e o restante (Qr) rejeitar para a fonte fria. Exemplo: o motor de um carro é a fonte quente, local onde ocorre a queima do combustível, que fornece o calor. Dessa fonte térmica é retirada, a cada ciclo, uma quantidade de calor. Parte deste calor é convertida em trabalho mecânico útil (energia útil), fazendo o carro se mover. A outra parte do calor que não é aproveitada é rejeitada para a atmosfera, fonte fria, por meio do escapamento.
![]() Como o rendimento de uma máquina térmica é sempre menor que 1 (η=W/Q, com W sempre menor que Q), Carnot demonstrou que, teoricamente, existe uma sequência específica de transformações na qual a máquina térmica obtém o máximo de rendimento. O ciclo no qual isso ocorre é denominado ciclo de Carnot e a máquina que opera segundo esse ciclo é chamada máquina de Carnot. Por ser ideal e imaginária, a máquina proposta por Carnot não contraria a segunda lei da Termodinâmica.
Como o rendimento de uma máquina térmica é sempre menor que 1 (η=W/Q, com W sempre menor que Q), Carnot demonstrou que, teoricamente, existe uma sequência específica de transformações na qual a máquina térmica obtém o máximo de rendimento. O ciclo no qual isso ocorre é denominado ciclo de Carnot e a máquina que opera segundo esse ciclo é chamada máquina de Carnot. Por ser ideal e imaginária, a máquina proposta por Carnot não contraria a segunda lei da Termodinâmica.
![]() A seqüência do ciclo de Carnot cuja máquina térmica que o realiza é denominada máquina de Carnot:
A seqüência do ciclo de Carnot cuja máquina térmica que o realiza é denominada máquina de Carnot:
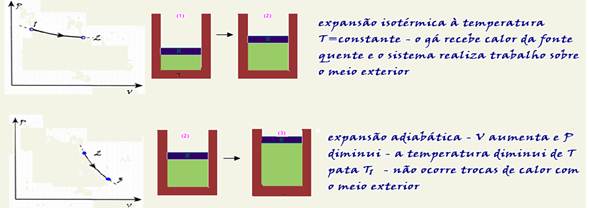
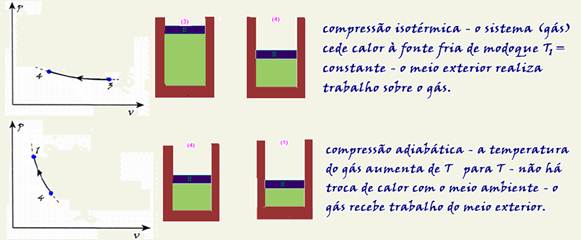
![]() Carnot demonstrou que o rendimento (η) de uma máquina térmica depende somente das temperaturas entre as quais ela trabalha ou que, no ciclo de Carnot, o rendimento é função exclusiva das temperaturas absolutas das fontes fria e quente e não depende da substância que faz a máquina térmica funcionar.
Carnot demonstrou que o rendimento (η) de uma máquina térmica depende somente das temperaturas entre as quais ela trabalha ou que, no ciclo de Carnot, o rendimento é função exclusiva das temperaturas absolutas das fontes fria e quente e não depende da substância que faz a máquina térmica funcionar.
Carnot demonstrou que:

R- A
Termometria – medida de temperatura
36- a) Falsa — C/5 = (F – 32)/9 — quando eles indicarem valores iguais C=F=x — x/5 = (x – 32)/9 — 5x – 160 = 9x — x=F=C= -40oC (quando a Celsius indicar – 40oC a Fahrenheit indicará também – 40oF).
b) Falsa — veja (a).
c) Correta — ∆C/5 = ∆F/9 — 5∆F=9∆C — ∆F=1,8∆C — a uma variação de 1o na escala Celsius corresponde uma variação de 1,8o na escala Fahrenheit.
d) Falsa — a altura da coluna líquida é a mesma para os dois termômetros, pois se trata do mesmo líquido e, portanto, para a mesma variação de temperatura sofrem a mesma dilatação volumétrica.
R- C.
37- Pode-se transformar uma indicação de uma escala para outra conforme o procedimento a seguir, de acordo com a relação matemática baseada no teorema de Thales:
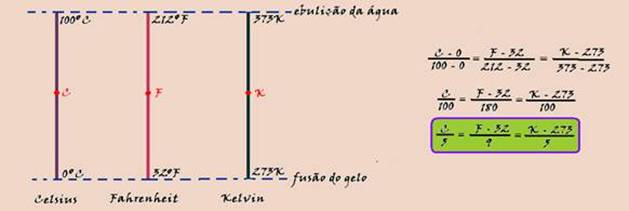
No caso do exercício — C/5 = (F – 32)/9 — C/5 = (10,4 – 32)/9 — C/5 = – 21,6/9 — C=- 108/9= – 12oC — R- C
Propagação do calor
69- Leia abaixo o processo de transferência de calor por condução:
Condução térmica
O calor é conduzido de um ponto a outro do corpo sem que haja deslocamento das partículas.

Explicando microscopicamente o fenômeno: a região próxima da chama tem o movimento vibratório de suas moléculas aumentado, adquirindo assim maior energia cinética, que é transferida através de choques às partículas vizinhas, que também aumentam seu movimento vibratório. Através desse transporte de energia, toda a barra é aquecida, pois os metais são bons condutores de calor — maneira que este tipo de cooler refrigera o processador segue um princípio bem simples: o calor gerado pelo processador é transferido devido à diferença de temperaturas entre eles, para o metal do cooler por condução, que ao mesmo tempo é resfriado pela corrente de ar trazida pela ventoinha, provocando nova transferência de calor do processador para o cooler e assim sucessivamente — vale ressaltar que a condução de calor do processador para o metal é potencializada por uma pasta térmica especial para este tipo de situação.
R- C.
70-
I. Verdadeira — O Efeito de Estufa consiste, basicamente, na ação do dióxido de carbono e outros gases sobre os raios infravermelhos refletidos pela superfície da terra, reenviando-os para ela, mantendo assim uma temperatura estável no planeta.
II. Verdadeira — A radiação solar, em sua maioria aquela dentro da região visível do espectro eletromagnético, aquece o nosso planeta naturalmente (Fonte:Ministério da Ciência e Tecnologia).
III. Falsa — Ao ser aquecida pela radiação solar, a superfície terrestre passa a emitir energia na forma de calor. Parte dessa energia se perde no espaço; o restante é absorvido por certos gases atmosféricos, presentes normalmente em quantidades muito pequenas. A energia absorvida é então irradiada de volta à superfície terrestre.
R- A.
71- 1o — Se o ASPS, região de alta pressão na atmosfera, funciona como uma “tampa” ele dificulta o movimento vertical do ar, inibindo, portanto, as correntes de convecção.
2o — De noite a Terra perde calor mais rapidamente devido à falta de nuvens e à pouca umidade da atmosfera na região do Atacama e essa falta de nuvens favorece a irradiação ou radiação do calor —R- C.
72- a) A intensidade da radiação solar absorvida pela placa coletora é igual ao quociente entre a potência P da placa coletora e a área S da mesma — I=P/S — 400 = P/2 — P=800W — essa potência P=800W é definida como sendo à razão entre a energia W absorvida pelo coletor (no caso, térmica, calor) e o respectivo intervalo de tempo ∆t=1,0min=60s — P=W/∆t — 800 = W/60 — W=Q=4.8000J=4,8.104J — equação fundamental da calorimetria — Q=m.c.∆θ — 4,8.104=6,103. ∆θ — ∆θ=4,8.104/6.103 — ∆θ=8,0oC.
b) Dados — To=290K — T=300K — ρo=1,2kg/m3 — m (constante) — P (constante) —densidade=massa/volume — ρ=m/V — V=m/ρ — Vo=m/ρo — equação geral dos gases perfeitos — P.Vo/To = P.V/T — (m/ρo)/To=(m/ρ)/T — ρo.To= ρ.T — 1,2×290 =ρ.300 — ρ=1,2×290/300=348/300 — ρ=1,16kg/m3.
Termologia
Conceitos iniciais
22- A pressão no interior do botijão é elevada (bem superior à pressão atmosférica) — devido a isto o gás no botijão está sob a forma líquida — neste caso o combustível dentro do botijão é denominado Gás Liquefeito de Petróleo – GLP — quando você abre o queimador a pressão passa a ser a pressão atmosférica, bem menos elevada e, nela, o GLP não pode existir sob a forma líquida: ele se transforma em gás (na forma gasosa) e escapa pelo queimador — se surgir uma faísca elétrica o gás se inflama — assim a transformação do líquido em gás não é causado pela chama: é causado pela queda da pressão. A chama foi causada pela fonte de calor Logo a afirmação C está errada — R- B.
Calorimetria
Calor sensível (específico) e trocas de calor sem mudança de estado
73- Trata-se de uma mistura de 25L de água passando de 34º C para 30º C com um volume V de água passando de 18º C para 30º C — mc(t – to) + mc(t – to)=0 — 25.c.(30 – 45) + V.c.(30 – 18)=0 — 12V=375 — V=31,25L (volume recebido da torneira) — volume total na banheira — V’=31,25 + 25=36,25L — tempo que a torneira demora para colocar 31,25L de água na banheira com vazão de 10L por minuto — ∆t=31,25/10=3,125minx60=187,5s —
R- C.
74- Supondo que não haja perdas de calor a quantidade de calor que um cede (negativa) é a mesma que o outro recebe (positiva), ou seja, Q1+ Q2 = 0 — m.c1.(tf – t1) + m.c2.(tf – t2)=0 — c1.tf – c1.t1 = c2.t2 – c2.tf — tf.(c1 + c2)=c1.t1 + c2.t2 — tf= (c1.t1 + c2.t2)/(c1 + c2) — R- C.
75- Se você não domina a teoria, ela está detalhada a seguir:
Princípio das trocas de calor
 Colocando vários corpos a diferentes temperaturas no interior de um recipiente adiabático, haverá trocas de calor entre eles, até atingirem o equilíbrio térmico.
Colocando vários corpos a diferentes temperaturas no interior de um recipiente adiabático, haverá trocas de calor entre eles, até atingirem o equilíbrio térmico.
Assim, como o recipiente é adiabático, a quantidade de calor cedida pelos corpos mais quentes é igual à quantidade de calor recebida pelos mais frios: Princípio da Conservação da energia.
Como a quantidade de calor recebida é positiva e a recebida é negativa, tem-se que — Q1 + Q2 + Q3 + ….+ QN = 0 ou
M1.c1.(t – t01) + m2.c2.(t – t02) + m3.c3.(t – to3) + … + mN.cN.(t – t0N) = 0
![]() Calorímetros – são recipientes adiabáticos onde se estuda as trocas de calor entre corpos que são colocados em seu
Calorímetros – são recipientes adiabáticos onde se estuda as trocas de calor entre corpos que são colocados em seu

interior.
Normalmente utiliza-se o calorímetro para se medir o calor específico de um corpo de massa (mc), mergulhando-o no interior do calorímetro, onde se tem água de massa (ma), um termômetro e um agitador de líquido.
Aquece-se o corpo cujo calor específico você deseja determinar e o introduz na água do calorímetro. Agita-se o sistema, espera ser atingido o equilíbrio térmico (te) que é medida.
Conhecendo as temperaturas iniciais da água e do corpo e o calor específico da água, determina-se o calor específico (cc) do corpo pela expressão — mc.cc.(te – toc) + ma.ca.(te – toa) = 0.
No caso do exercício, observe que o calorímetro e a massa de 100g de água a 2º C que já estavam em seu interior não vão influir nas trocas de calor já que as temperaturas inicial e final são iguais (20º C) — assim, os 200g de água a 100º C devem passar para a água a 20º C quando misturados com uma massa m de água a 0o C, que também deve passar para 20º C — Qcedido + Qrecebido=0 — 200.1.(20 – 100) + m.1.(20 – 0) = 0 — 16000 = 20m — m=800g — R- B.
76- Substituindo na expressão fornecida T(t) = (To – Tar).10 – t/12 + Tar, To=740º C, T(t)=140º C e Tar=40º C — 140 = (740 – 40).10-t/12 + 40 — 100=700×10-t/12 — 1 = 7×10-t/12 — 1/7 = 10-t/12 — log(1/7) = log(10-t/12) — log(7-1) = -(t/12). log10 — -log(7) = – t/12 — t=12.log(7) minutos — R- C.
77- a) A intensidade da radiação solar absorvida pela placa coletora é igual ao quociente entre a potência P da placa coletora e a área S da mesma — I=P/S — 400 = P/2 — P=800W — essa potência P=800W é definida como sendo à razão entre a energia W absorvida pelo coletor (no caso, térmica, calor) e o respectivo intervalo de tempo ∆t=1,0min=60s — P=W/∆t — 800 = W/60 — W=Q=4.8000J=4,8.104J — equação fundamental da calorimetria — Q=m.c.∆θ — 4,8.104=6,103. ∆θ — ∆θ=4,8.104/6.103 — ∆θ=8,0oC.
b) Dados — To=290K — T=300K — ρo=1,2kg/m3 — m (constante) — P (constante) —densidade=massa/
volume — ρ=m/V — V=m/ρ — Vo=m/ρo — equação geral dos gases perfeitos — P.Vo/To = P.V/T — (m/ρo)/To=(m/ρ)/T — ρo.To= ρ.T — 1,2×290 =ρ.300 — ρ=1,2×290/300=348/300 — ρ=1,16kg/m3.
Calor Latente – trocas de calor com mudança de estado
57- Pelos dados você pode observar que no final haverá água líquida à temperatura t — calor cedido por m=10g de gelo a -10oC até água a t — Q1=m.cgelo.(t – to) + m.L + m.cágua.(t – to)=10.0,5.{0 – (-10)} + 10.80 + 10.1.(t -0) — Q1=10t + 850 — calor cedido por 90g de água para a 50oC até chegar a água a t — Q2=mcágua.(t – to)=90.1.(t – 50) — Q2=90t – 4500 — Q1 + Q2=0 — 10t + 850 + 90t – 4500 = 0 — 100t=3650 — t=36,50oC — R-C.
58- De água a 20oC a água a 100oC — não tem mudança de estado (calor sensível) — Q1=m.c.(t – to) — Q1=0,5.4.2.103(100 – 20) — Q1=32.104J — de água a 100oC a vapor a 100oC — mudança de estado (calor latente) — Q2=m.L —Q2=0,5.2,26.106 — Q2=1,13.106J — Qtotal=32.104 + 113.104 =145.104=1,45.106J — R- D.
59- Trata-se apenas de uma mudança de estado (fusão a 0oC) — Q=m.LF=3.10.80=2400=2,4.103cal — R- E.
60- De gelo a – 4oC a água a 0oC — não tem mudança de estado — Q1=m.csólido.(θ – θo)=100.0,5.[0 – (- 4)]=200 cal — de gelo a 0oC a água a 0oC — é uma mudança de estado (fusão) — Q2=m.Lfusão=100.80=8000 cal — de água a 0oC a água a 37oC — não tem mudança de estado — Q3= m.clíquido.(θ – θo) =100.1 (37 – 0)=3700 cal — Qtotal=Q1 + Q2 + Q3=20 + 8000 + 3700 — Qtotal=11900 cal=11,9 kcal — R- D.
61- a) Observe pelo gráfico que no estado sólido, enquanto a temperatura do corpo sobe de OoC até 4oC o corpo absorve a quantidade de calor de Q1=400cal — calor específico no estado sólido (cs) — Q1=m.cs.(θ – θo) — 400 =
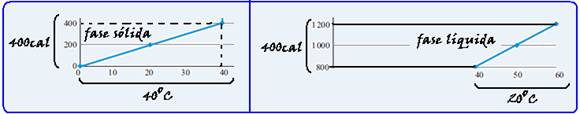
100.cs.(40 – 0) — cs=400/4000 — cs=0,1caç/goC — na fase líquida enquanto a temperatura do corpo sobe de 400C para 60oC são absorvidas Q2=(1200 – 800)=400cal — Q2=m.cl. (θ – θo) — 400=100.cl.(60 – 40) — cl=400/2000 — cl=0,2cal/goC.
b) A fusão ocorre quando a substância passa de sólido a 40oC para líquido a 40oC , assim sua temperatura de fusão é
40oC — para se fundir ela recebe Q3=800 – 400=400cal — calor latente de fusão — Q3=mLf — 400=100Lf — Lf=4cal/g.
Dilatometria
Dilatação linear, superficial e volumétrica
78- 01. Correta — equação fundamental da calorimetria — Q=m.c.(t – to)=1.0,5.(50 – 20) —Q=15kcal=15000cal — Q=1,5.104cal.
02. Correta — ∆ℓ = ℓo.α.(t – to)=0,5.2.10-6.(50 – 20) — ∆ℓ = 30.10-6m=3.10-3cm.
04.Correta — C=∆Q/∆t=15000/30 — C=5.102=500cal/oC.
08- Falsa — seria o dobro se o calor específico da barra fosse o dobro.
16. Falsa — se o comprimento da barra aumenta, sua densidade linear deve diminuir (d=m/ℓ – d e ℓ são inversamente proporcionais)
R- (01. 02. 04)
79- Expressão da dilatação linear — ∆L=Loα∆θ — ∆L/∆θ=Loα — sendo as duas retas paralelas a tangente do ângulo θ entre as duas é a mesma — tgθ=∆LB/∆θ=∆LA/∆θ — ∆LB = ∆LA — LoB.αB = LoB.αB — 2LαB = LαA — αA/αB=2.
R- A.
Termodinâmica
Mudanças de estado físico
52- I. A água que está no estado líquido é resfriada até temperaturas abaixo de 0oC se congelando, ou seja, passando para o estado sólido — seta 2 do gráfico — II. Em câmaras especiais, sob baixíssima pressão (menores do que 0,006 atm), a temperatura do alimento é elevada, fazendo com que a água sólida seja sublimada, ou seja, o gelo (estado sólido) passa para a fase de vapor — seta 3 do gráfico — R- C.
Transformações gasosas
52- a) Entre 1 e 2 trata-se de uma transformação isotérmica cujas características são fornecidas a seguir:
![]() Nela, durante todo o processo, a temperatura permanece constante (isso=igual; thermos=temperatura) — o cientista Robert Boyle comprovou que, quando a temperatura é constante, a pressão (P) exercida por certa massa gasosa é inversamente proporcional ao volume (V) por ela ocupado — ou — P.V=constante — ou ainda — Po.Vo=P.V — P e Vo representam a pressão e o volume num estado de equilíbrio inicial — P e V representam a pressão e o volume num estado de equilíbrio final.
Nela, durante todo o processo, a temperatura permanece constante (isso=igual; thermos=temperatura) — o cientista Robert Boyle comprovou que, quando a temperatura é constante, a pressão (P) exercida por certa massa gasosa é inversamente proporcional ao volume (V) por ela ocupado — ou — P.V=constante — ou ainda — Po.Vo=P.V — P e Vo representam a pressão e o volume num estado de equilíbrio inicial — P e V representam a pressão e o volume num estado de equilíbrio final.
![]()
![]() Sendo P = k / V, se V tende a zero P cresce indefinidamente e se V cresce indefinidamente p tende a zero e, se você representar graficamente P x V você obterá uma curva de nome isoterma que é um ramo de uma hipérbole eqüilátera.
Sendo P = k / V, se V tende a zero P cresce indefinidamente e se V cresce indefinidamente p tende a zero e, se você representar graficamente P x V você obterá uma curva de nome isoterma que é um ramo de uma hipérbole eqüilátera.
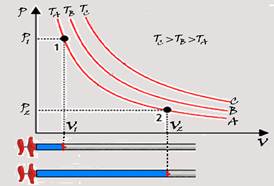
Cada ponto da curva (isoterma) A tem a mesma temperatura (TA); Cada ponto da curva (isoterma) B tem a mesma temperatura (TB) e cada ponto da curva (isoterma) C tem a mesma temperatura (TC).
Pelo gráfico são fornecidos — P1=5.105Pa, V1=3.10-5m3, P2=3.105Pa e V2=? — P1.V1=P2.V2 — 5.105.3.10-5=3.105.
V2 — V2=15.10-5/3 — V2=5.10-5m3.
b) No trecho compreendido entre 2 e 3 ocorre uma transformação adiabática cuja expressão matemática é P.Vγ=constante, ou seja, P2.V2γ=P3.V3γ — P3=P2.V2γ /V3γ — substituindo os respectivos valores — P3=3.105.
(5.10-5/6.10-5) 3/2 = 3.105.√53/63) — P3=3.105.√0,58=3.105.0,77 — P3≈2,3.105Pa.
53- São fornecidos — P2/P1=0,26 — P2=0,26P1 — T1/T2≈1,3 — T1≈1,3T2 — substituindo esses valores na equação fornecida P1/T1μ1=P2/T2μ2 — P1/1,3T2μ1=0,26P1/T2μ2 — (1/1,3)μ1=0,26/μ2 — μ2=0,338μ1 — μ2/μ1=0,338≈0,34 — R- E.
54- I. A água que está no estado líquido é resfriada até temperaturas abaixo de 0oC se congelando, ou seja, passando para o estado sólido — seta 2 do gráfico — II. Em câmaras especiais, sob baixíssima pressão (menores do que 0,006 atm), a temperatura do alimento é elevada, fazendo com que a água sólida seja sublimada, ou seja, o gelo (estado sólido) passa para a fase de vapor — seta 3 do gráfico — R- C.
Trabalho de um gás – transformação cíclica
27- Toda transformação cíclica deve obedecer às seguintes condições:
![]() Como as temperaturas final e inicial são coincidentes (Ti=Tf), a variação de energia interna (ΔU) é nula — ΔU=0
Como as temperaturas final e inicial são coincidentes (Ti=Tf), a variação de energia interna (ΔU) é nula — ΔU=0
![]() ΔU=Q – W — 0=Q – W — Qciclo=Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
ΔU=Q – W — 0=Q – W — Qciclo=Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
![]()
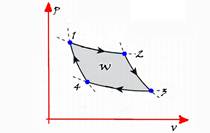
![]() Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
![]() Se o ciclo é realizado no sentido horário, o trabalho é positivo.
Se o ciclo é realizado no sentido horário, o trabalho é positivo.
![]() Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
O trabalho realizado é obtido pela área do ciclo (triângulo) — W=bxh/2=(10 – 2).(10 – 2)/2=64/2=32J (positivo-ciclo no sentido horário) — R- C.
28- Na expansão AB o trabalho realizado é fornecido por W=P.∆V=P.(VB – VA)=4.105.(1 – 0,3)=2,8.105 J — WAB= =2,8.105J — sendo a transformação ABCDA cíclica, as temperaturas final e inicial são as mesmas e, portanto, não há variação de energia interna ∆Utotal=0 — ∆Utotal=∆UAB + ∆UBC + ∆UCD + ∆UDA=0 (I) — primeiro princípio da termodinâmica no trecho AB — ∆UAB=QAB– WAB — QAB=400kJ=4.105J (dado) — ∆UAB=4.105 – 2,8.105 — ∆UAB=1,2.105J — ∆UBC=0 (isotérmica) — primeiro princípio da termodinâmica no trecho CD — ∆UCD=QCD – WCD — QCD= – 440kJ= – 4,4.105J (negativo, pelo enunciado perdeu calor para o meio externo) — WCD=P.(VD – VC)=2.105.(0,5 – 2) — WCD= – 3.105J — ∆UCD=QCD – WCD= – 4,4.105 – (-3.105)= – 1,4.105J — substituindo as energias internas em (I) — 1,2.105 + 0 – 1,4.105 + ∆UDA = 0 — ∆UDA=0,2.105=2.104J.
29- Toda transformação cíclica deve obedecer às seguintes condições:
![]() Como as temperaturas final e inicial são coincidentes (Ti=Tf), a variação de energia interna (ΔU) é nula — ΔU=0
Como as temperaturas final e inicial são coincidentes (Ti=Tf), a variação de energia interna (ΔU) é nula — ΔU=0
![]() ΔU=Q – W — 0=Q – W — Qciclo=Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
ΔU=Q – W — 0=Q – W — Qciclo=Wciclo (a quantidade de calor trocada com o meio externo é igual ao trabalho realizado na transformação)
![]()
![]() Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
Em toda transformação cíclica representada no diagrama PxV, o trabalho realizado é fornecido pela área do ciclo.
![]() Se o ciclo é realizado no sentido horário, o trabalho é positivo.
Se o ciclo é realizado no sentido horário, o trabalho é positivo.
![]() Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
Se o ciclo é realizado no sentido anti-horário, o trabalho é negativo.
O trabalho realizado é obtido pela área do ciclo (triângulo) — W=bxh/2=(10 – 2).(10 – 2)/2=64/2=32J (positivo-ciclo no sentido horário) — R- C.
Primeiro Princípio da Termodinâmica ou Princípio da Conservação da energia
58- Trata-se do Primeiro Princípio da Termodinâmica ou Princípio da Conservação da energia que afirma que: “A energia não pode ser criada nem destruída, mas apenas transformada”
Suponha que um sistema isolado receba 300J de calor. Se, por exemplo, 50J dessa energia forem absorvidos pelo sistema, então a parte restante, 250J, será fornecida ao ambiente sob a forma de trabalho.

Então, Q= W + ΔU ou,
![]()
A expressão acima é a representação matemática do primeiro princípio da termodinâmica.
R- C.
59- Na expansão AB o trabalho realizado é fornecido por W=P.∆V=P.(VB – VA)=4.105.(1 – 0,3)=2,8.105 J — WAB= =2,8.105J — sendo a transformação ABCDA cíclica, as temperaturas final e inicial são as mesmas e, portanto, não há variação de energia interna ∆Utotal=0 — ∆Utotal=∆UAB + ∆UBC + ∆UCD + ∆UDA=0 (I) — primeiro princípio da termodinâmica no trecho AB — ∆UAB=QAB– WAB — QAB=400kJ=4.105J (dado) — ∆UAB=4.105 – 2,8.105 — ∆UAB=1,2.105J — ∆UBC=0 (isotérmica) — primeiro princípio da termodinâmica no trecho CD — ∆UCD=QCD – WCD — QCD= – 440kJ= – 4,4.105J (negativo, pelo enunciado perdeu calor para o meio externo) — WCD=P.(VD – VC)=2.105.(0,5 – 2) — WCD= – 3.105J — ∆UCD=QCD – WCD= – 4,4.105 – (-3.105)= – 1,4.105J — substituindo as energias internas em (I)
Segunda lei da Termodinâmica
49- O motor de um carro é a fonte quente, local onde ocorre a queima do combustível, que fornece o calor. Dessa fonte térmica é retirada, a cada ciclo, uma quantidade de calor. Parte deste calor é convertida em trabalho mecânico útil (energia útil), fazendo o carro se mover. A outra parte do calor que não é aproveitada é rejeitada para a atmosfera, fonte fria, por meio do escapamento — o fator que limita a busca pela eficiência total de um motor é a segunda lei da Termodinâmica ao afirmar que o rendimento de uma máquina térmica é sempre menor que 1 (100%), impedindo que a transformação de calor em trabalho seja integral.
R- B.
50- Todas são falsas — veja fisicaevestibular.com.br — Física Térmica – Segundo Princípio da Termodinâmica — R- C.
51-
Resumo da teoria do ciclo de Carnot:
Carnot demonstrou que o rendimento (η) de uma máquina térmica depende somente das temperaturas entre as quais ela trabalha ou que, no ciclo de Carnot, o rendimento é função exclusiva das temperaturas absolutas das fontes fria e quente e não depende da substância que faz a máquina térmica funcionar.
Carnot demonstrou que:

Dados — trabalho útil — W=3200J — W=Q – Q1 — 3200= Q – Q1 — Q1= Q – 3200 (I) — temperatura da fonte fria — T1=77 + 273=350K — temperatura da fonte quente — T= 427 + 273 =700K — η = 1 – T1/T — η = 1 – 350/700 — η = 1 – 1/2 — η = 1/2=0,5×100=50% — η = 1 – Q1/Q (II) — (I) em (II) — 1/2 = 1 – (Q – 3200)/Q — 1/2 = (Q – 3200)/Q — Q = 2Q – 6400 — Q=6400J (quantidade de calor recebido da fonte quente) — Q1=3200J (quantidade de calor rejeitado para a fonte fria) — R- B.
Voltar para os exercícios
